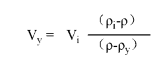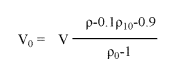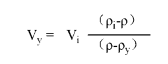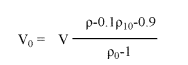产品描述
Percoll是一种适用性广且操作灵活简单的低密度梯度分离液,可用来分离细胞,亚细胞颗粒,细菌,病毒,甚至实现受损细胞及其碎片与完整活细胞的分离。Percoll主要由表面包被单层乙烯吡咯烷酮(PVP)的硅胶颗粒组成,直径15-30 nm,游离PVP的含量仅占1-2%。由于颗粒大小的异质化,离心过程以不同的速率沉淀,自发产生一个匀质化且等渗的梯度,密度在1.0-1.3 g/mL之间。大部分沉淀系数>60S的生物颗粒都可以用Percoll实现分离。
本品是无菌的溶液,呈无色至浅黄色,具有以下几大特点,
1)Percoll形成的梯度密度范围在1.0-1.3 g/mL之间,整个梯度体系都是等渗的;
2)无细胞毒性,化学惰性,不会粘附到细胞膜上;
3)可调节至生理离子强度和pH;
4)温和条件分离细胞,亚细胞颗粒和较大病毒(低至~70S),可保持其活力和形态完整性;
5)只需角转头中速离心即可实现预成梯度或者自发形成梯度分离;
6)Percoll粘度低(10±5 cP at 20°C),能够快速形成梯度和颗粒分离;采用预制梯度分离低速离心力(200-1000 × g)仅需数分至数十分钟即可达到满意的分离结果;
7)Percoll稳定性高,未开封的产品室温保存5年有效;开封的产品室温无菌保存至少2年有效;
8)Percoll(未稀释)可重新高压灭菌,120°C,30 min;
使用方法
1. 不同浓度(密度)Percoll溶液的制备
注意:Percoll最好稀释于缓冲液,生理盐水或0.25 M 蔗糖溶液中。细胞样本可用缓冲液如PBS来进行梯度分离;而亚细胞颗粒,有可能会在盐离子存在的情况下聚集在一起,建议使用蔗糖溶液(终浓度0.25 M)来进行梯度分离。
1)等渗Percoll溶液(SIP)的制备
也就是将未稀释的Percoll原液调整到等渗透于生理盐溶液。取9份Percoll(v/v)加入1份1.5 M NaCl,10×浓缩培养基,1.5 M PBS或2.5 M 蔗糖溶液混匀即可。可通过加入盐离子或者蒸馏水来调整渗透压到最后需要的值。细胞密度取决于渗透压,因此,SIP溶液的渗透压常规来说需要用渗压计来调整以确保实验间结果的可重复性。通过以下公式来计算SIP溶液的密度,

此公式中,Vx= volume of diluting medium (mL);V0= volume of undiluted Percoll (mL)
ρ0= density of Percoll (1.130+0.005 g/mL);
ρ10= density of 1.5 M NaCl=1.058 g/mL(minor differences for other salts);
density of 2.5 M sucrose=1.316 g/mL(minor differences for other additives)
ρi= density of SIP solution produced(g/mL)
Thus, for SIP in saline, ρi=1.123 g/mL and for SIP in sucrose, ρi=1.149 g/mL, assuming ρ0=1.130 g/mL.
2)稀释SIP溶液至更低密度
直接使用0.15 M NaCl或1×细胞培养液(正常渗透压)稀释SIP到需要的密度,用于细胞分离;直接使用0.25 M 蔗糖溶液稀释SIP用于亚细胞或者病毒分离。通过以下公式来计算调整SIP到需要的密度,
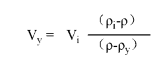
此公式中,Vy= volume of diluting medium in mL; Vi= volume of SIP in mL;
ρi= density of SIP in g/mL; ρ = density of diluted solution produced in g/mL;
ρy= density of diluting medium in g/mL
(density of 0.15 M NaCl is~1.0046 g/mL)
(density of 0.25 M sucrose is~1.032 g/mL)
例如:To dilute 55 mL of SIP to a final density of 1.07 g/mL,determine the amount of 0.15 M NaCl required.
Volume of 0.15 M NaCl required =55×  =44.6 mL
=44.6 mL
注意:以上公式调整得到的实际密度仅仅与预定密度非常接近,并不能保证完全相同。因为加入体积和稀释液密度的微小变化都会影响最终结果。要想知道实际密度,建议使用密度计或折射仪来测定。
2. 一步法稀释Percoll到需要密度(可选)
根据以下方法直接将Percoll原液稀释到已知密度的工作液。在量筒内,加入1.5 M NaCl或2.5 M 蔗糖到1/10终体积溶液,然后用蒸馏水稀释到最终体积量。根据以下公式计算需要的Percoll原液的体积,
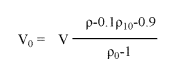
此公式中,V0= volume of undiluted Percoll (mL); V= volume of final working solution (mL);
ρ0= density of Percoll (undiluted) (g/mL); ρ= desired density of final solution (g/mL)
ρ10= density of 1.5 M NaCl=1.058 g/mL (minor differences for other salts)
density of 2.5 M sucrose=1.316 g/mL (minor differences for other additives)
例如:To prepare 100 mL of working solution of Percoll of density 1.07 g/mL in 0.15 M NaCl. To 10 mL of 1.5 M NaCl, add

 Volume of Percoll required =100×
Volume of Percoll required =100×  =49.4 mL (if percoll density is 1.130 g/mL)
=49.4 mL (if percoll density is 1.130 g/mL)
and make up to 100 mL with distilled water.
注意:以上公式调整得到的实际密度仅仅与预定密度非常接近,并不能保证完全相同。因为加入体积和稀释液密度的微小变化都会影响最终结果。要想知道实际密度,建议使用密度计或折射仪来测定。
3. 不连续(Discontinuous)密度梯度的制备
1) 根据以上公式将SIP溶液稀释到需要的一系列不同密度;
2) 先将试管壁用牛血清湿润,除去多余血清,这种预处理可使逐层叠加的Percoll液平稳沿管壁流下,使形成满意的界面。使用枪头或者宽口针头的注射器按照高密度向低密度逐层放置的先后顺序,紧贴管壁,任液体自然慢慢流下,确保上层溶液不会溅入下层或者混入分界处。
1. 装样:样品体积和细胞浓度根据不同细胞而异,一般加样体积不宜过大,细胞浓度也不可过高,否则会影响细胞的分离和回收。
2. 离心:一般采用离心力为400 × g,时间20~25 min。由于多层Percoll之间密度差别不大,因此离心机加速、降速时要慢,要平稳。
3. 取样:当所要分离的细胞绝大部分在两层的界面时,可逐层去除Percoll液后收集界面部位的细胞;有时大部分细胞位于Percoll层中,则需要逐层收集。
4. 清洗:Percoll由于没有细胞毒性,且不会粘附在细胞膜上,通常来说没有必要去除。细胞可直接转入培养体系,病毒可直接进行感染,细胞器可直接用于代谢功能研究等。也可以根据以下方法来进行清洗,去除percoll。
1)细胞样本的低速清洗
收获含有Percoll液的活细胞层,用生理盐水或者PBS缓冲液按照5:1的体积比清洗2~3次,每次用200 × g离心2-10 min回收细胞;
2)病毒或者亚细胞的高速清洗
病毒或者亚细胞由于太小难以用低速离心收集获得,可在吊篮式转头或角转头离心机中高速离心分离这些样本。收获含有Percoll液的分离层放入离心管内,以吊篮式转头100,000×g,2 h或者角转头100,000×g,90 min的条件离心沉淀Percoll颗粒。需要的生物样本保留在上层溶液。
分离纯化细胞举例
1)富含NK活性大颗粒淋巴细胞(LGL)的纯化:按顺序由下向上逐层加50%、47.5%、45%、42.5%和40%五种不同密度的Percoll,如用10 mL试管(或塑料管)分离,每层Percoll约1.2~1.5 mL,初步从外周血中分离的PBMC细胞1×108悬于1 mL培基中,按要求装样、离心和取样。一般富含NK杀伤活性的LGL细胞位于42.5%与45%Percoll界面以及上下二层的Percoll液中。
2)纯化淋巴母细胞和除去死细胞:分别叠加50%和30%Percoll液。收取经PHA(或其它抗原、有丝分裂原)刺激PBMC,或含有较高比例异型的PBMC(如肾综合征出血热患者),按要求装样、离心和取样。位于管底的淋巴细胞为小淋巴细胞;两层Percoll之间为淋巴母细胞,纯度和回收率在80%以上,位于30%Percoll表面是死细胞。收获淋巴母细胞可进行表型、结构以及功能的研究。
人不同血细胞的漂浮密度
|
细胞
|
漂浮密度
|
细胞
|
漂浮密度
|
|
红细胞
|
1.09-1.11
|
淋巴细胞
|
1.052-1.077
|
|
嗜酸性
|
1.09-1.095
|
B淋巴细胞
|
1.062-1.075
|
|
嗜中性
|
1.080-1.085
|
T淋巴细胞
|
1.065-1.077
|
|
单核细胞
|
1.050-1.066
|
淋巴母细胞
|
1.065-1.077
|
|
血小板
|
1.030-1.060
|
自然杀伤细胞
|
1.050-1.070
|
运输与保存方法
室温运输。未开封前4-30℃保存,有效期5年。开封后于无菌条件2-8℃保存。若以非无菌的条件保存,产品要冻存在-20℃(需要预留足够的膨胀空隙)以防止微生物生长,最长6个月稳定。可能冻存的Percoll溶液再次融化后会形成梯度,需要在使用前充分混匀。
注意事项
1)Percoll分离推荐使用聚碳酸酯(PC)离心管;Percoll离心后常有二氧化硅颗粒聚集在管底,或者分层时聚集在管壁上。干燥后这些沉淀较难去除,因此建议使用后立即用水冲洗所用设备。
2)Percoll在pH 5.5-10之间性能不受任何干扰。但低于pH 5.5会发生胶凝。二价阳离子也会引起胶凝,而温度升高会加剧此现象发生。
3)只有不含盐离子或蔗糖的Percoll(原液)才能高压灭菌。因为盐离子会引起胶凝,而蔗糖会引起焦糖化。高压灭菌过程尽量减少与空气接触,避免在percoll/空气层间形成固体颗粒,可通过将percoll装在窄口瓶内来避免。如果颗粒已经形成,通过过滤或者低速离心的方式去除。灭菌后溶液的损失可加入相应体积的蒸馏水补足,密度不会受影响。Percoll不可用滤膜除菌。
4)为了您的安全和健康,请穿实验服并戴一次性手套操作。
5)本产品仅作科研用途!
HB231214