DNA分选磁珠(完美替代AMPure XP磁珠)|Hieff NGS® DNA Selection Beads
产品说明书
FAQ
COA
已发表文献
产品描述
Hieff NGS® DNA Selection Beads基于SPRI (Solid Phase Reverse Immobilization)原理,配合精心优化过的缓冲体系,可用于二代测序文库构建过程中的DNA片段分选、纯化。本产品可适用于各品牌的DNA、RNA建库试剂盒,和目前广泛使用的AMPure XP Beads使用方式相同,片段回收效率和文库大小分布均与AMPure XP Beads高度吻合。
运输与保存方法
冰袋运输。2-8℃保存,效期一年。避免冷冻!
注意事项
1)为了您的安全和健康,请穿实验服并戴一次性手套操作。
2)磁珠使用前须在室温平衡至少30 min。
3)80%乙醇需现用现配,否则将影响回收效率。
4)进行长度分选时,初始样品体积需≥100μL,不足时请用超纯水补齐。样品体积太小,将导致移液误差增大,进而影响分选的准确性。
5) 本产品仅用作科研用途!
使用方法
1. 准备工作
将磁珠由冰箱中取出,室温平衡至少30 min。配制80%乙醇。
2. 长度分选(双轮法)
长度分选操作流程如图1所示,具体操作如下。
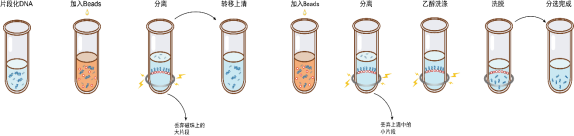
图1双轮分选操作流程
1)请涡旋振荡或充分颠倒磁珠以保证混匀。
2)根据要求,参考表1向DNA溶液中加入第一轮分选磁珠,涡旋混匀或移液器吹打10次混匀。
3)室温孵育5 min。
4)将离心管短暂离心并置于磁力架中,待溶液澄清后(约5 min),小心转移上清到干净的离心管中。
注意:转移上清时,请残留2 μL液体于管底,切勿全部吸出上清,避免吸到磁珠并影响分选效果。
举例:当初始体积为100 μL,第一轮使用0.8×比例,即加入80 μL磁珠,推荐吸出178 μL的上清。
5)参考表1向上清中加入第二轮分选磁珠。
6)涡旋混匀或移液器吹打10次混匀,室温静置5 min。
7)将离心管短暂离心并置于磁力架中,待溶液澄清后(约5 min),小心移除上清。
8)保持离心管始终处于磁力架中,加入200 μL新鲜配制的80%乙醇漂洗磁珠,室温孵育30 s,小心移除上清。
9)重复步骤8。
10)保持离心管始终处于磁力架中,开盖干燥磁珠至刚刚出现龟裂(约5 min)。
注意:切记磁珠不要干燥时间太久,磁珠干燥过度将影响纯化效果。
11)将离心管从磁力架中取出,加入适量ddH2O(≥20 μL),涡旋振荡或使用移液器轻轻吹打充分混匀,室温孵育5 min。
12)将离心管短暂离心并置于磁力架中分离磁珠和液体。待溶液澄清后(约5 min),小心吸取上清至干净的管中,即完成分选。
3. DNA片段分选参考条件
通过超声法将小牛胸腺DNA进行片段化,制备100-1000 bp的Smear片段,根据表1进行双轮分选。结果使用Agilent 2100 Bioanalyzer进行分析(图2)。
表1磁珠文库分选推荐比例
|
DNA片段大小 |
250-350 bp |
320-420 bp |
450-550 bp |
550-700 bp |
700-900 bp |
800-1000 bp |
|
第一轮体积比(Beads:DNA) |
0.80× |
0.70× |
0.60× |
0.55× |
0.50× |
0.45× |
|
第二轮体积比(Beads:DNA) |
0.20× |
0.20× |
0.20× |
0.15× |
0.15× |
0.15× |
注:表中“×”表示样品DNA体积。如文库插入片段长度为250 bp,样品DNA体积为100mL,则第一轮分选磁珠使用体积为0.80×100 mL=80 mL;第二轮分选磁珠使用体积为0.20×100 mL=20 mL。
![]()
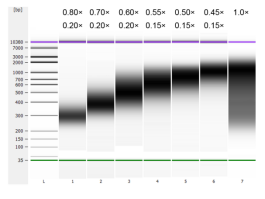
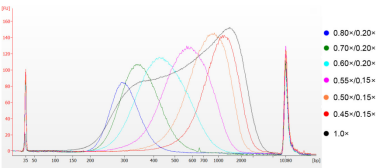
图2 Agilent 2100 high sensitivity DNA chip electopherogram
Smear fragments溶于ddH2O,使用0.80×/0.20×至0.45×/0.15×磁珠进行片段分选
HB220528
产品描述
Hieff NGS® DNA Selection Beads基于SPRI (Solid Phase Reverse Immobilization)原理,配合精心优化过的缓冲体系,可用于二代测序文库构建过程中的DNA片段分选、纯化。本产品可适用于各品牌的DNA、RNA建库试剂盒,和目前广泛使用的AMPure XP Beads使用方式相同,片段回收效率和文库大小分布均与AMPure XP Beads高度吻合。
运输与保存方法
冰袋运输。2-8℃保存,效期一年。避免冷冻!
注意事项
1)为了您的安全和健康,请穿实验服并戴一次性手套操作。
2)磁珠使用前须在室温平衡至少30 min。
3)80%乙醇需现用现配,否则将影响回收效率。
4)进行长度分选时,初始样品体积需≥100μL,不足时请用超纯水补齐。样品体积太小,将导致移液误差增大,进而影响分选的准确性。
5) 本产品仅用作科研用途!
使用方法
1. 准备工作
将磁珠由冰箱中取出,室温平衡至少30 min。配制80%乙醇。
2. 长度分选(双轮法)
长度分选操作流程如图1所示,具体操作如下。
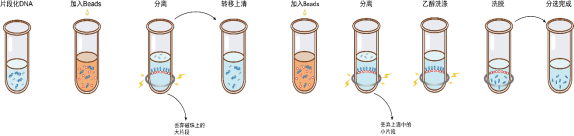
图1双轮分选操作流程
1)请涡旋振荡或充分颠倒磁珠以保证混匀。
2)根据要求,参考表1向DNA溶液中加入第一轮分选磁珠,涡旋混匀或移液器吹打10次混匀。
3)室温孵育5 min。
4)将离心管短暂离心并置于磁力架中,待溶液澄清后(约5 min),小心转移上清到干净的离心管中。
注意:转移上清时,请残留2 μL液体于管底,切勿全部吸出上清,避免吸到磁珠并影响分选效果。
举例:当初始体积为100 μL,第一轮使用0.8×比例,即加入80 μL磁珠,推荐吸出178 μL的上清。
5)参考表1向上清中加入第二轮分选磁珠。
6)涡旋混匀或移液器吹打10次混匀,室温静置5 min。
7)将离心管短暂离心并置于磁力架中,待溶液澄清后(约5 min),小心移除上清。
8)保持离心管始终处于磁力架中,加入200 μL新鲜配制的80%乙醇漂洗磁珠,室温孵育30 s,小心移除上清。
9)重复步骤8。
10)保持离心管始终处于磁力架中,开盖干燥磁珠至刚刚出现龟裂(约5 min)。
注意:切记磁珠不要干燥时间太久,磁珠干燥过度将影响纯化效果。
11)将离心管从磁力架中取出,加入适量ddH2O(≥20 μL),涡旋振荡或使用移液器轻轻吹打充分混匀,室温孵育5 min。
12)将离心管短暂离心并置于磁力架中分离磁珠和液体。待溶液澄清后(约5 min),小心吸取上清至干净的管中,即完成分选。
3. DNA片段分选参考条件
通过超声法将小牛胸腺DNA进行片段化,制备100-1000 bp的Smear片段,根据表1进行双轮分选。结果使用Agilent 2100 Bioanalyzer进行分析(图2)。
表1磁珠文库分选推荐比例
|
DNA片段大小 |
250-350 bp |
320-420 bp |
450-550 bp |
550-700 bp |
700-900 bp |
800-1000 bp |
|
第一轮体积比(Beads:DNA) |
0.80× |
0.70× |
0.60× |
0.55× |
0.50× |
0.45× |
|
第二轮体积比(Beads:DNA) |
0.20× |
0.20× |
0.20× |
0.15× |
0.15× |
0.15× |
注:表中“×”表示样品DNA体积。如文库插入片段长度为250 bp,样品DNA体积为100mL,则第一轮分选磁珠使用体积为0.80×100 mL=80 mL;第二轮分选磁珠使用体积为0.20×100 mL=20 mL。
![]()
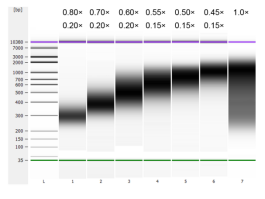
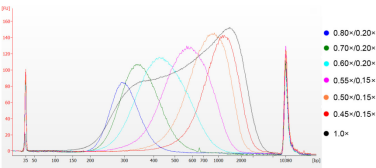
图2 Agilent 2100 high sensitivity DNA chip electopherogram
Smear fragments溶于ddH2O,使用0.80×/0.20×至0.45×/0.15×磁珠进行片段分选
HB220528
Q:12601可以用来纯化DNA吗?
A:可以纯化150bp以上的DNA片段,如果纯化的DNA中含有较多的150bp以下的建议用货号12600的产品,可以纯化50bp以上的DNA。
Q:12601可以分选1Kb或以上的DNA片段吗?
A:需要自行摸索体系,目前筛选的片段范围确定的体系为说明中的体系,其它片段分选的可以参考说明书中的分选体系调整。
Q: 不小心将磁珠放到-20℃,但未结冰,是否可以继续使用?
A:不建议使用。因为低温会破坏磁珠的结构,使得磁珠的抓取效率降低,影响磁珠回收性能。
Q:磁珠未开封的时候 4℃保存,开封后一直室温保存使用,是否会影响磁珠的回收性能?
A:室温放置对磁珠的回收性能会有一定影响,不建议室温放置太久,使用完后建议 4℃ 保存。PEG 分离效果易受 pH、温度等影响。
Q:磁珠原理
A:1) DNA 分选磁珠:基于一种固相载体可逆化固定(SPRI)的分离纯化方法,磁珠体系一般包含:磁珠、DNA、PEG、盐离子(主要是 Na+)等。在一定浓度的 PEG 和盐离子环境中,DNA 可通过 Na+桥吸附到羧基修饰的高分子磁珠表面(即固相载体),该过程是可逆的,在不同的 PEG 浓度条件下,结合的 DNA 分子可以被洗脱回收。
2)RNA 纯化磁珠:目前还没有报道明确的原理,一般来说也是静电吸附,但如何做到特异性吸附 RNA,目前我们也不清楚(因为磁珠不是我们生产的,这类产品商家都有各自的专利和机密)。
3)RNA 富集磁珠:磁珠上偶联了 Oligo(dT)的微米级顺磁性微球,在一定浓度的缓冲液中通过与带有poly(A)尾巴的mRNA 相结合,将mRNA 从总RNA 中进行分离纯化。
Q:磁珠回收率低可能的原因是什么?
A:1)磁珠与DNA 混匀不充分,未能充分吸附。建议反应体系充分混匀;
2)磁珠比例不对,建议按照说明书进行选择合适的比例;
3)孵育时间不足,保证孵育时间至少 5 min;
4)磁珠分选时,二轮磁珠吸附的时候吸到磁珠。可在 200 μL 枪头前串联 10μL 枪头用于移液,可防止吸到磁珠;
5)磁珠洗涤时的乙醇非现配,导致乙醇浓度过低,建议乙醇浓度不低于 70%;
6)干燥过度:磁珠长时间干燥导致表面龟裂,DNA 难以洗脱,得率降低;建议干燥时间不宜过长,表面刚出现龟裂即可;
7)洗脱液体积不足:最终洗脱液应完全覆盖管内磁珠。
Q:12601可以纯化或回收150bp以下的片段吗?
A:不建议使用12601,建议使用12600,最低可回收100bp左右的片段,50bp以上的回收率可能会有影响。
Q:是否可以纯化单链DNA,该使用多少磁珠?
A:磁珠可以吸附双链DNA和单链DNA,但不能区分单链或双链DNA。磁珠纯化单链DNA的倍数可以参考双链的说明书。
[1]He J, Liu T, Wang W, Wu X, Wang J, Yan W. Comprehensive improvement of soil quality and rice yield by flooding-midseason drying-flooding. Appl Microbiol Biotechnol. 2022;106(21):7347-7359. doi:10.1007/s00253-022-12184-7(IF:5.560)
[2]Wang X, Yuan Q, Zhang W, et al. Sequence specific integration by the family 1 casposase from Candidatus Nitrosopumilus koreensis AR1. Nucleic Acids Res. 2021;49(17):9938-9952. doi:10.1093/nar/gkab725(IF:19.160)
[3]Duan XZ, Sun JT, Wang LT, et al. Recent infection by Wolbachia alters microbial communities in wild Laodelphax striatellus populations. Microbiome. 2020;8(1):104. Published 2020 Jul 2. doi:10.1186/s40168-020-00878-x(IF:16.837)
[4]Ghosh S, Yang X, Wang L, Zhang C, Zhao L. Active phase prebiotic feeding alters gut microbiota, induces weight-independent alleviation of hepatic steatosis and serum cholesterol in high-fat diet-fed mice. Comput Struct Biotechnol J. 2020;19:448-458. Published 2020 Dec 24. doi:10.1016/j.csbj.2020.12.011(IF:6.155)
[5]Gao X, Yu B, Yu J, et al. Developmental Profiling of Dietary Carbohydrate Digestion in Piglets. Front Microbiol. 2022;13:896660. Published 2022 Apr 29. doi:10.3389/fmicb.2022.896660(IF:6.064)
[6]Li P, Zhang Y, Yan F, Zhou X. Characteristics of a Bacteriophage, vB_Kox_ZX8, Isolated From Clinical Klebsiella oxytoca and Its Therapeutic Effect on Mice Bacteremia. Front Microbiol. 2021;12:763136. Published 2021 Dec 3. doi:10.3389/fmicb.2021.763136(IF:6.064)
[7]Lin Z, Luo P, Huang D, Wu Y, Li F, Liu H. Multi-omics based strategy for toxicity analysis of acrylamide in Saccharomyces cerevisiae model. Chem Biol Interact. 2021;349:109682. doi:10.1016/j.cbi.2021.109682(IF:5.168)
[8]Sun X, Lv W, Wang Y, et al. Mrgprb2 gene plays a role in the anaphylactoid reactions induced by Houttuynia cordata injection. J Ethnopharmacol. 2022;289:115053. doi:10.1016/j.jep.2022.115053(IF:5.195)
[9]Ma H, Lai B, Zan C, Di X, Zhu X, Wang K. GLO1 Contributes to the Drug Resistance of Escherichia coli Through Inducing PER Type of Extended-Spectrum β-Lactamases. Infect Drug Resist. 2022;15:1573-1586. Published 2022 Apr 5. doi:10.2147/IDR.S358578(IF:4.177)
[10]Zhong Y, Zhao W, Tang Z, et al. Comparative transcriptomic analysis of the different developmental stages of ovary in red swamp crayfish Procambarus clarkii. BMC Genomics. 2021;22(1):199. Published 2021 Mar 21. doi:10.1186/s12864-021-07537-x(IF:4.547)
[11]Lian C, Yang H, Lan J, et al. Comparative analysis of chloroplast genomes reveals phylogenetic relationships and intraspecific variation in the medicinal plant Isodon rubescens. PLoS One. 2022;17(4):e0266546. Published 2022 Apr 6. doi:10.1371/journal.pone.0266546(IF:3.752)
[12]Diao G, Huang J, Zheng X, et al. Prostaglandin E2 serves a dual role in regulating the migration of dendritic cells. Int J Mol Med. 2021;47(1):207-218. doi:10.3892/ijmm.2020.4801(IF:5.314)
[13]Bing XL, Zhao DS, Peng CW, Huang HJ, Hong XY. Similarities and spatial variations of bacterial and fungal communities in field rice planthopper (Hemiptera: Delphacidae) populations. Insect Sci. 2020;27(5):947-963. doi:10.1111/1744-7917.12782(IF:3.605)
[14]Li X, Zhou S, Zhang J, Zhou Z, Xiong Q. Directional Changes in the Intestinal Bacterial Community in Black Soldier Fly (Hermetia illucens) Larvae. Animals (Basel). 2021;11(12):3475. Published 2021 Dec 6. doi:10.3390/ani11123475(IF:3.231)
[15]Yang J, Peng Y, Kong W. Identification and complete genome sequence of mulberry cryptic virus 1. Arch Virol. 2022;167(2):687-690. doi:10.1007/s00705-021-05350-1(IF:2.685)
[16]Liu S, Luorong Q, Hu K, et al. Aqueous Extract of Lysimachia christinae Hance Prevents Cholesterol Gallstone in Mice by Affecting the Intestinal Microflora. J Microbiol Biotechnol. 2021;31(9):1272-1280. doi:10.4014/jmb.2106.06043(IF:3.277)
[17]Chang Y, Xia X, Sui L, et al. Endophytic colonization of entomopathogenic fungi increases plant disease resistance by changing the endophytic bacterial community. J Basic Microbiol. 2021;61(12):1098-1112. doi:10.1002/jobm.202100494(IF:2.650)
[18]Ding CY, Ma YM, Li B, et al. Identification and Functional Analysis of Differentially Expressed Genes in Myzus persicae (Hemiptera: Aphididae) in Response to Trans-anethole. J Insect Sci. 2022;22(1):3. doi:10.1093/jisesa/ieab094(IF:2.066)
[19]Liu QH, Wang ZY, Tang JW, et al. Comparative transcriptome analysis of diurnal alterations of liver glycogen structure: A pilot study. Carbohydr Polym. 2022;295:119710. doi:10.1016/j.carbpol.2022.119710(IF:10.723)
[20]Huang C, Mei Q, Lou L, et al. Ulcerative Colitis in Response to Fecal Microbiota Transplantation via Modulation of Gut Microbiota and Th17/Treg Cell Balance. Cells. 2022;11(11):1851. Published 2022 Jun 5. doi:10.3390/cells11111851(IF:7.666)
[21]Jing F, YR Zheng, Xin Z,et al, Effect of supercritical carbon dioxide on bacterial community, volatile profiles and quality changes during storage of Mongolian cheese, Food Control, Volume 143,2023,https://doi.org/10.1016/j.foodcont.2022.109225(IF:6.652)
[22]Huang C, Gao F, Zhou H, et al. Oral Microbiota Profile in a Group of Anti-AChR Antibody-Positive Myasthenia Gravis Patients. Front Neurol. 2022;13:938360. Published 2022 Jul 7. doi:10.3389/fneur.2022.938360(IF:4.086)
