Fluo-4,AM钙离子荧光探针(细胞可渗透) Fluo-4钙离子探针
产品说明书
FAQ
COA
已发表文献
产品描述
细胞生物学实验中常使用Fluo-3, AM作为一种荧光探针来检测细胞内钙离子浓度变化。其检测原理基于Fluo-3,AM可穿透细胞膜进入细胞,之后被细胞内的酯酶剪切形成Fluo-3,从而被滞留在细胞内。Fluo-3游离配体几乎是非荧光性的,其荧光不会随钙离子浓度升高而增强。但是,当它与细胞内钙离子结合后可以产生较强的荧光,荧光会增加60至80倍。
Fluo-4, AM是钙指示剂Fluo-3,AM的升级版本,主要变化为后者分子上的两个氯原子被Fluo-4,AM上的氟所取代,该结构上的微小变化使Fluo-4,AM加载更快,在相同浓度下检测信号更强。
本产品为Fluo-4,AM粉末状,用于细胞内钙离子检测时,Fluo-4, AM的常用浓度为0.5-5 μM。
产品性质
|
CAS 号(CAS NO.) |
273221-67-3 |
|
分子式(Molecular Fomular) |
C51H50F2N2O23 |
|
分子量(Molecular Weight) |
1096.94 |
|
Ex/Em(nm, Ca2+-bound) |
Ex/Em=494 nm/516 nm |
|
纯度(HPLC Purity) |
≥90% |
|
外观(Appearance) |
橙红色粉末 |
|
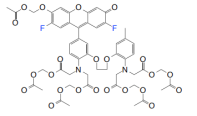
结构式(Structure) |
|
运输与保存方法
室温运输。-20℃干燥避光保存,有效期一年。
注意事项
1)荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
2)乙酰氧基甲基酯(Acetoxymethyl ester,AM)容易吸潮,从冰箱取出后,请确认在干燥的环境放至室温后再开封。由于试剂极其微量,开封前请将其短暂离心,以保证粉末落入管底。
3)第一次使用时,建议母液现配现用。且溶解后的试剂尽可能在短时间内使用,以保证实验效果。
4)母液遇水极易分解,若单次不能用完,建议分装保存,例如5μl/管,用封口膜封口,并严格做到≤-20℃密封干燥保存。
5)建议您在正式实验前先摸索一下细胞量、钙离子荧光探针的终浓度、培养时间等,找到最佳实验条件。
6)为了您的安全和健康,请穿实验服并戴一次性手套操作。
7)本产品仅作科研用途!
需要试剂准备
1) (可选)配制Pluronic F-127母液:100mg Pluronic F-127粉末(Cat No. 60318ES60)中加入0.5 mL DMSO,配制成20%(w/v)的DMSO母液。溶解过程需要在40-50℃加热20-30 min。溶液室温保存,不要冷藏。如果有结晶析出,可以重新加热后溶解,不影响使用。
2)Hanks•balanced salt solution
操作方法
1)Fluo-4,AM母液的配制:向 Fluo-4, AM中加入适量DMSO,配制成1-5 mM的储存液,DMSO的加入量根据Fluo-4,AM(MW1096.94)分子量进行计算(如:若配制成1 mM的母液,需向50 µg Fluo-4,AM中加入45.6 µL DMSO)。
【注】:溶解用的DMSO需要保证新鲜无水,否则将会导致 AM 水解,使荧光染料无法进入细胞,影响实验效果。
2)Fluo-4,AM工作液的配制:利用HBSS将Fluo-4,AM稀释成1-5 µM的工作液,具体稀释方法如1 mM母液配制1 mL浓度为4 µM工作液,用1 mLHBSS溶液稀释4 µL 1 mM母液即可。
【注】:① 推荐该探针加载浓度在4-5 µM,具体的使用浓度需根据实验要求进行优化。为了避免过度加载造成细胞毒性,建议在取得有效结果的基础上尽量使用最低探针浓度。
② Fluo-4,AM工作液需现配现用,避免反复冻存。
3)(可选)如果Fluo-4进入细胞的效果不好,可向 Fluo-4, AM/DMSO 溶液中加入适量20% Pluronic F-127溶液,最终稀释至其终浓度为0.04-0.05%,Pluronic F-127 可以防止 Fluo-4, AM 在 HBSS中聚合并能帮助其进入细胞。同时,可将丙磺舒(1-2mM)添加到染料工作溶液中(最终孔浓度为0.5-1mM),以减少脱酯化指标的泄漏。
【注】:Pluronic F-127可降低Fluo-4,AM的稳定性,因此只建议在配制工作液时加入,不建议将其加入储存液长期保存。
4)取出预培养的细胞,除去培养基,使用 HBSS 溶液洗涤细胞 3次。
【注】:如果使用含血清的培养基,血清中的酯酶会分解 AM 基团,从而降低 Fluo 4-AM 进入细胞的效果。另外含有酚红的培养基会使本底值略微偏高,所以加工作液之前需尽量去除培养基残留。
5)将 Fluo-4, AM工作液加入细胞,加入量以覆盖细胞为准。在37℃培养10-60 min,然后除去 Fluo 4-AM 工作液。
【注】:① 关于孵育的时间,如果首次做实验不能确定,建议先孵育30 min,看荧光效果:如果细胞死亡较多,适当缩短时间;如果荧光强度太弱,适当延长时间。
② 降低加载温度可能会减少探针AM酯运载技术造成的探针区室化。
6)用HBSS溶液洗涤细胞 3 次,以充分去除残留的 Fluo 4-AM 工作液。然后加入 HBSS 溶液覆盖细胞。
7)37℃培养箱孵育约20-30 min,以确保AM 基团在细胞内的完全去酯化作用。
【注】:(可选)对于含有阴离子通道蛋白的细胞,5-7步骤中可加入有机阴离子转运抑制剂probenecid(1-2.5mM)或sulfinpyrazone(0.1-0.25 mM)到细胞外液以减少指示剂去酯后的渗漏。
8)用激光共聚焦或荧光显微镜检测细胞,激发波长 494 nm,发射波长 516 nm。
【注】:Fluo-4,AM进入胞内后,经酯酶降解形成Fluo-4,并不是以共价结合的形式滞留在细胞质内。因此不可对加载染料的活细胞进行固定处理,再进行Ca2+水平检测。
HB220823
产品描述
细胞生物学实验中常使用Fluo-3, AM作为一种荧光探针来检测细胞内钙离子浓度变化。其检测原理基于Fluo-3,AM可穿透细胞膜进入细胞,之后被细胞内的酯酶剪切形成Fluo-3,从而被滞留在细胞内。Fluo-3游离配体几乎是非荧光性的,其荧光不会随钙离子浓度升高而增强。但是,当它与细胞内钙离子结合后可以产生较强的荧光,荧光会增加60至80倍。
Fluo-4, AM是钙指示剂Fluo-3,AM的升级版本,主要变化为后者分子上的两个氯原子被Fluo-4,AM上的氟所取代,该结构上的微小变化使Fluo-4,AM加载更快,在相同浓度下检测信号更强。
本产品为Fluo-4,AM粉末状,用于细胞内钙离子检测时,Fluo-4, AM的常用浓度为0.5-5 μM。
产品性质
|
CAS 号(CAS NO.) |
273221-67-3 |
|
分子式(Molecular Fomular) |
C51H50F2N2O23 |
|
分子量(Molecular Weight) |
1096.94 |
|
Ex/Em(nm, Ca2+-bound) |
Ex/Em=494 nm/516 nm |
|
纯度(HPLC Purity) |
≥90% |
|
外观(Appearance) |
橙红色粉末 |
|
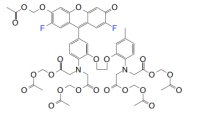
结构式(Structure) |
|
运输与保存方法
室温运输。-20℃干燥避光保存,有效期一年。
注意事项
1)荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
2)乙酰氧基甲基酯(Acetoxymethyl ester,AM)容易吸潮,从冰箱取出后,请确认在干燥的环境放至室温后再开封。由于试剂极其微量,开封前请将其短暂离心,以保证粉末落入管底。
3)第一次使用时,建议母液现配现用。且溶解后的试剂尽可能在短时间内使用,以保证实验效果。
4)母液遇水极易分解,若单次不能用完,建议分装保存,例如5μl/管,用封口膜封口,并严格做到≤-20℃密封干燥保存。
5)建议您在正式实验前先摸索一下细胞量、钙离子荧光探针的终浓度、培养时间等,找到最佳实验条件。
6)为了您的安全和健康,请穿实验服并戴一次性手套操作。
7)本产品仅作科研用途!
需要试剂准备
1) (可选)配制Pluronic F-127母液:100mg Pluronic F-127粉末(Cat No. 60318ES60)中加入0.5 mL DMSO,配制成20%(w/v)的DMSO母液。溶解过程需要在40-50℃加热20-30 min。溶液室温保存,不要冷藏。如果有结晶析出,可以重新加热后溶解,不影响使用。
2)Hanks•balanced salt solution
操作方法
1)Fluo-4,AM母液的配制:向 Fluo-4, AM中加入适量DMSO,配制成1-5 mM的储存液,DMSO的加入量根据Fluo-4,AM(MW1096.94)分子量进行计算(如:若配制成1 mM的母液,需向50 µg Fluo-4,AM中加入45.6 µL DMSO)。
【注】:溶解用的DMSO需要保证新鲜无水,否则将会导致 AM 水解,使荧光染料无法进入细胞,影响实验效果。
2)Fluo-4,AM工作液的配制:利用HBSS将Fluo-4,AM稀释成1-5 µM的工作液,具体稀释方法如1 mM母液配制1 mL浓度为4 µM工作液,用1 mLHBSS溶液稀释4 µL 1 mM母液即可。
【注】:① 推荐该探针加载浓度在4-5 µM,具体的使用浓度需根据实验要求进行优化。为了避免过度加载造成细胞毒性,建议在取得有效结果的基础上尽量使用最低探针浓度。
② Fluo-4,AM工作液需现配现用,避免反复冻存。
3)(可选)如果Fluo-4进入细胞的效果不好,可向 Fluo-4, AM/DMSO 溶液中加入适量20% Pluronic F-127溶液,最终稀释至其终浓度为0.04-0.05%,Pluronic F-127 可以防止 Fluo-4, AM 在 HBSS中聚合并能帮助其进入细胞。同时,可将丙磺舒(1-2mM)添加到染料工作溶液中(最终孔浓度为0.5-1mM),以减少脱酯化指标的泄漏。
【注】:Pluronic F-127可降低Fluo-4,AM的稳定性,因此只建议在配制工作液时加入,不建议将其加入储存液长期保存。
4)取出预培养的细胞,除去培养基,使用 HBSS 溶液洗涤细胞 3次。
【注】:如果使用含血清的培养基,血清中的酯酶会分解 AM 基团,从而降低 Fluo 4-AM 进入细胞的效果。另外含有酚红的培养基会使本底值略微偏高,所以加工作液之前需尽量去除培养基残留。
5)将 Fluo-4, AM工作液加入细胞,加入量以覆盖细胞为准。在37℃培养10-60 min,然后除去 Fluo 4-AM 工作液。
【注】:① 关于孵育的时间,如果首次做实验不能确定,建议先孵育30 min,看荧光效果:如果细胞死亡较多,适当缩短时间;如果荧光强度太弱,适当延长时间。
② 降低加载温度可能会减少探针AM酯运载技术造成的探针区室化。
6)用HBSS溶液洗涤细胞 3 次,以充分去除残留的 Fluo 4-AM 工作液。然后加入 HBSS 溶液覆盖细胞。
7)37℃培养箱孵育约20-30 min,以确保AM 基团在细胞内的完全去酯化作用。
【注】:(可选)对于含有阴离子通道蛋白的细胞,5-7步骤中可加入有机阴离子转运抑制剂probenecid(1-2.5mM)或sulfinpyrazone(0.1-0.25 mM)到细胞外液以减少指示剂去酯后的渗漏。
8)用激光共聚焦或荧光显微镜检测细胞,激发波长 494 nm,发射波长 516 nm。
【注】:Fluo-4,AM进入胞内后,经酯酶降解形成Fluo-4,并不是以共价结合的形式滞留在细胞质内。因此不可对加载染料的活细胞进行固定处理,再进行Ca2+水平检测。
HB220823
Q:有哪些比较常见的可见光激发Ca2+荧光探针?
A:Fluo-3 是最常用的可见光激发 Ca2+荧光探针、Fluo-4 是钙指示剂Fluo-3 的升级版本、Rhod-2 是另一种可见光激发的高亲和力Ca2+指示剂。
Q:几种探针的应用的位置?
A:如果是测定胞质内的钙离子建议选择 Fluo-3、4,如果是测定细胞器内较浓钙离子的实验建议采用Rhod-2
Q:通过流式细胞仪可以使用什么指示剂染料来测量钙通量?
A:Indo-1 是流式细胞术的首选染色剂,使用单一激光器进行激发(通常是氩离子激光器的 351-364 nm 谱线)并监测两种发射,Indo-1 的发射最大值从无 Ca2 +培养基中〜475nm 转变为当染料被 Ca2+结合饱和时的〜400nm。Indo-1 比较适用于多色荧光应用。
Q:荧光探针用什么缓冲液稀释?
A:工作液用最好是使用无血清培养基、HBSS 或是 PBS 等缓冲液进行稀释,稀释后的探针工作液即可直接加入细胞进行检测。
Q:荧光探针装载完多久后观察?
A:为减少各种可能的误差,尽量缩短探针装载后到仪器测定所用的时间(刺激时间除外)。
Q:Fura-2 为什么需要两次不同的激发和发射测定?
A:结合 Ca2+后的最大激发波长从结合前的 380nm 向 340nm(Ca2+饱和时)偏移,其发射荧光强度与结合 Ca2+的浓度存 在定量关系。一般用 340nm 和 380nm 波长激发 Fura-2,在 510nm 处检测发射波长。通过使用与两种激发对应的荧光强度比 率来计算细胞内的钙离子浓度,这种比率测量方法可以消除不同细胞样品间荧光探针装载效率的差异,荧光探针的渗漏,细 胞厚度差异等一些误差因素。
Q:我需要用 Fluo-4 标记细胞进行钙通量分析。标记后多久可以保留染料?
A:将染料加入细胞后,细胞内酯酶从染料中除去'AM'部分。当'AM'基团被移除时,染料能够结合钙和发出荧光。由于染 料不与任何细胞成分共价结合,因此可能会主动从细胞中流出。流出速度取决于细胞的固有特性,培养条件和其他因素。染料可能会保留数小时,数天甚至数周,或在几分钟内丢失。建议染色后应立即进行检测,也可以使用丙磺舒限制主动外流 造成的损失。
Q:加载 Fluo-4 染料检测钙后可以固定细胞吗?
A:不能。因为 Fluo-4 不与任何细胞成分共价结合并且固定会损害膜,染料将不会被细胞保留。
[1] Huang X, Qiu M, Wang T, et al. Carrier-free multifunctional nanomedicine for intraperitoneal disseminated ovarian cancer therapy. J Nanobiotechnology. 2022;20(1):93. Published 2022 Feb 22. doi:10.1186/s12951-022-01300-4(IF:10.435)
[2] Liu C, Li L, Lyu J, et al. Split bullets loaded nanoparticles for amplified immunotherapy. J Control Release. 2022;347:199-210. doi:10.1016/j.jconrel.2022.05.011(IF:9.776)
[3] Wu T, Wang X, Cheng J, et al. Nitrogen-doped graphene quantum dots induce ferroptosis through disrupting calcium homeostasis in microglia. Part Fibre Toxicol. 2022;19(1):22. Published 2022 Mar 24. doi:10.1186/s12989-022-00464-z(IF:9.400)
[4] Peng Q, Guo X, Luo Y, et al. Dynamic Immune Landscape and VZV-Specific T Cell Responses in Patients With Herpes Zoster and Postherpetic Neuralgia. Front Immunol. 2022;13:887892. Published 2022 Jun 1. doi:10.3389/fimmu.2022.887892(IF:8.786)
[5] Zhong G, Long H, Chen F, Yu Y. Oxoglaucine mediates Ca2+ influx and activates autophagy to alleviate osteoarthritis through the TRPV5/calmodulin/CAMK-II pathway. Br J Pharmacol. 2021;178(15):2931-2947. doi:10.1111/bph.15466(IF:8.740)
[6] Dong T, Zhao Y, Jin HF, et al. SNTA1-deficient human cardiomyocytes demonstrate hypertrophic phenotype and calcium handling disorder. Stem Cell Res Ther. 2022;13(1):288. Published 2022 Jun 30. doi:10.1186/s13287-022-02955-4(IF:8.079)
[7] Shen B, Wang S, Bharathi G, et al. Rapid and Targeted Photoactivation of Ca2+ Channels Mediated by Squaraine To Regulate Intracellular and Intercellular Signaling Processes. Anal Chem. 2020;92(12):8497-8505. doi:10.1021/acs.analchem.0c01243(IF:6.785)
[8] Jin T, Lin J, Gong Y, et al. iPLA2β Contributes to ER Stress-Induced Apoptosis during Myocardial Ischemia/Reperfusion Injury. Cells. 2021;10(6):1446. Published 2021 Jun 9. doi:10.3390/cells10061446(IF:6.600)
[9] Li J, Qi F, Su H, et al. GRP75-faciliated Mitochondria-associated ER Membrane (MAM) Integrity controls Cisplatin-resistance in Ovarian Cancer Patients. Int J Biol Sci. 2022;18(7):2914-2931. Published 2022 Apr 11. doi:10.7150/ijbs.71571(IF:6.582)
[10] Liang X, Wu T, Tang M. Microarray analysis of gene expression differences in microglia after exposure to graphene quantum dots. Sci Total Environ. 2020;749:141385. doi:10.1016/j.scitotenv.2020.141385(IF:6.551)
[11] Chang J, Guo Y, Li J, et al. Positive Interaction between H2O2 and Ca2+ Mediates Melatonin-Induced CBF Pathway and Cold Tolerance in Watermelon (Citrullus lanatus L.). Antioxidants (Basel). 2021;10(9):1457. Published 2021 Sep 14. doi:10.3390/antiox10091457(IF:6.313)
[12] Wang X, Yan K, Fu M, et al. EspF of Enterohemorrhagic Escherichia coli Enhances Apoptosis via Endoplasmic Reticulum Stress in Intestinal Epithelial Cells: An Isobaric Tags for Relative and Absolute Quantitation-Based Comparative Proteomic Analysis. Front Microbiol. 2022;13:900919. Published 2022 Jun 30. doi:10.3389/fmicb.2022.900919(IF:6.064)
[13] Peng S, Song C, Li H, et al. Circular RNA SNX29 Sponges miR-744 to Regulate Proliferation and Differentiation of Myoblasts by Activating the Wnt5a/Ca2+ Signaling Pathway. Mol Ther Nucleic Acids. 2019;16:481-493. doi:10.1016/j.omtn.2019.03.009(IF:5.919)
[14] Li N, Liu B, Wu W, et al. Upregulation of transcription factor 4 downregulates NaV1.8 expression in DRG neurons and prevents the development of rat inflammatory and neuropathic hypersensitivity. Exp Neurol. 2020;327:113240. doi:10.1016/j.expneurol.2020.113240(IF:5.330)
[15] Yan Q, Gao H, Yao Q, Ling K, Xiao G. Loss of phosphatidylinositol-4-phosphate 5-kinase type-1 gamma (Pip5k1c) in mesenchymal stem cells leads to osteopenia by impairing bone remodeling. J Biol Chem. 2022;298(3):101639. doi:10.1016/j.jbc.2022.101639(IF:5.157)
[16] Zhang Z, Pan T, Sun Y, et al. Dietary calcium supplementation promotes the accumulation of intramuscular fat. J Anim Sci Biotechnol. 2021;12(1):94. Published 2021 Sep 10. doi:10.1186/s40104-021-00619-6(IF:5.032)
[17] Wu J, Zhang R, Hu G, Zhu HH, Gao WQ, Xue J. Carbon Monoxide Impairs CD11b+Ly-6Chi Monocyte Migration from the Blood to Inflamed Pancreas via Inhibition of the CCL2/CCR2 Axis. J Immunol. 2018;200(6):2104-2114. doi:10.4049/jimmunol.1701169(IF:4.539)
[18] Meng X, Zeng Z, Gao J, et al. Conformational changes in bovine α-lactalbumin and β-lactoglobulin evoked by interaction with C18 unsaturated fatty acids provide insights into increased allergic potential. Food Funct. 2020;11(10):9240-9251. doi:10.1039/d0fo02028a(IF:4.171)
[19] Luo M, Liu Y, Liu N, et al. Proscillaridin A inhibits hepatocellular carcinoma progression through inducing mitochondrial damage and autophagy. Acta Biochim Biophys Sin (Shanghai). 2021;53(1):19-28. doi:10.1093/abbs/gmaa139(IF:3.848)
[20] Wu W, He S, Shen Y, et al. Natural Product Luteolin Rescues THAP-Induced Pancreatic β-Cell Dysfunction through HNF4α Pathway. Am J Chin Med. 2020;48(6):1435-1454. doi:10.1142/S0192415X20500706(IF:3.682)
[21] Li X, Chen M, Yang Z, Wang W, Lin H, Xu S. Selenoprotein S silencing triggers mouse hepatoma cells apoptosis and necrosis involving in intracellular calcium imbalance and ROS-mPTP-ATP. Biochim Biophys Acta Gen Subj. 2018;1862(10):2113-2123. doi:10.1016/j.bbagen.2018.07.005(IF:3.679)
[22] Lv N, Yuan J, Ji A, et al. Perfluorooctanoic acid-induced toxicities in chicken embryo primary cardiomyocytes: Roles of PPAR alpha and Wnt5a/Frizzled2. Toxicol Appl Pharmacol. 2019;381:114716. doi:10.1016/j.taap.2019.114716(IF:3.585)
[23] Xiao J, Feng X, Huang XY, et al. Spautin-1 Ameliorates Acute Pancreatitis via Inhibiting Impaired Autophagy and Alleviating Calcium Overload. Mol Med. 2016;22:643-652. doi:10.2119/molmed.2016.00034(IF:3.530)
[24] Wei T, Liu L, Zhou X. Cortex Dictamni extracts inhibit over-proliferation and migration of rat airway smooth muscle cells via FAK/p38/Bcl-2 signaling pathway. Biomed Pharmacother. 2018;102:1-8. doi:10.1016/j.biopha.2018.03.039(IF:3.457)
[25] Chen Y, Sun T, Niu Y, et al. A partial loss-of-function variant in GNRNR gene in a Chinese cohort with idiopathic hypogonadotropic hypogonadism. Transl Androl Urol. 2021;10(4):1676-1687. doi:10.21037/tau-20-1390(IF:3.150)
[26] Tian C, Li S, He L, et al. Transient receptor potential ankyrin 1 contributes to the lysophosphatidylcholine-induced oxidative stress and cytotoxicity in OLN-93 oligodendrocyte. Cell Stress Chaperones. 2020;25(6):955-968. doi:10.1007/s12192-020-01131-y(IF:2.892)
[27] Tian C, Han X, He L, et al. Transient receptor potential ankyrin 1 contributes to the ATP-elicited oxidative stress and inflammation in THP-1-derived macrophage. Mol Cell Biochem. 2020;473(1-2):179-192. doi:10.1007/s11010-020-03818-3(IF:2.795)
[28] Liang J, Chen F, Gu F, Liu X, Li F, Du D. Expression and functional activity of bitter taste receptors in primary renal tubular epithelial cells and M-1 cells. Mol Cell Biochem. 2017;428(1-2):193-202. doi:10.1007/s11010-016-2929-1(IF:2.669)
[29] Xu W, Lu C, Zhang F, Shao J, Zheng S. Dihydroartemisinin restricts hepatic stellate cell contraction via an FXR-S1PR2-dependent mechanism. IUBMB Life. 2016;68(5):376-387. doi:10.1002/iub.1492(IF:2.653)
[30] Zhu D, Chen C, Xia Y, Kong LY, Luo J. A Purified Resin Glycoside Fraction from Pharbitidis Semen Induces Paraptosis by Activating Chloride Intracellular Channel-1 in Human Colon Cancer Cells. Integr Cancer Ther. 2019;18:1534735418822120. doi:10.1177/1534735418822120(IF:2.634)
[31] Yue X, Liang J, Gu F, Du D, Chen F. Berberine activates bitter taste responses of enteroendocrine STC-1 cells. Mol Cell Biochem. 2018;447(1-2):21-32. doi:10.1007/s11010-018-3290-3(IF:2.561)
[32] Jin X, Xu Z, Fan R, et al. HO‑1 alleviates cholesterol‑induced oxidative stress through activation of Nrf2/ERK and inhibition of PI3K/AKT pathways in endothelial cells. Mol Med Rep. 2017;16(3):3519-3527. doi:10.3892/mmr.2017.6962(IF:1.692)